Citologia y biopsia ecoguiada
MV. Osacar Juan MCITOLOGÍA Y BIOPSIA TRU-CUT ECOGUIADA EN CANINOS Y FELINOS
Osácar Juan M, Gabriela Citriano, Matías N. Tellado
INTRODUCCIÓN
El manejo terapéutico de las enfermedades oncológicas requiere un diagnóstico para su óptimo abordaje. La necesidad de contar con el mismo permite estandarizar correctamente si el paciente requerirá quimioterapia neoadyuvante, cirugía oncológica, electroquimioterapia, terapia adyuvante con radioterapia o una combinación de las anteriores, y el momento para poder realizarlas. Los métodos complementarios imagenológicos: radiografía, tomografía computada, ecografía, etc. permiten estadificar al paciente oncológico y poder identificar la ubicación de la neoplasia primaria y sus posibles secundarismos. Dentro de ellos la ecografía es una de las herramientas más difundidas, útiles, dinámicas y versátiles (Sahoo et al. 2020; Cuccovillo and Lamb 2002). Al ser de alta sensibilidad y baja especificidad debe apoyarse en la anamnesis, signos clínicos, resultados de laboratorio, así como de la citología e histopatología. Por su parte la misma nos permite definir a grandes rasgos, y entendiendo los alcances y limitantes de la técnica: tamaño, vascularización (doppler color y/o power), ecogenicidad y ubicación, esta última importante cuando se desea realizar toma de muestras para poder obtener un diagnóstico. Es necesario contar con un ecografista formado y entrenado en la visualización de las diferentes patologías oncológicas, con equipos de buena calidad e idealmente contar con transductores lineales y convexos que permitan visualizar con diferentes detalles los órganos en cuestión.
Como se mencionó al principio es indispensable un diagnóstico para poder realizar un manejo oncológico correcto. El método gold standard en las neoplasias en caninos y felinos es por el momento el análisis histopatológico con o sin la necesidad de inmunohistoquímica según la patología en cuestión (Meuten 2016). La posibilidad de realizar una biopsia incisional o escisional para contar con una muestra para su análisis no siempre es factible cuando la ubicación del tumor se encuentra en órganos parenquimatosos: hígado, bazo, riñón, pulmón, linfonodos abdominales o torácicas, etc. En estos casos realizar laparotomía exploratoria para poder llegar a un diagnóstico puede llegar a ser un método invasivo, que si la patología en cuestión no es de resolución quirúrgica o requiere el uso de tratamiento neoadyuvante, puede llegar a ser innecesaria su utilización en primera instancia. Tener un conocimiento amplio sobre las diferentes patologías oncológicas, prevalencias en caninos y felinos, ubicaciones más frecuentes nos permitirán tomar las mejores decisiones para su diagnóstico y los métodos para llegar al mismo. Además contar con toda la información posible para poder abordar al paciente oncológico antes de su resolución final, no garantiza pero mejora considerablemente su tratamiento.
CITOLOGÍA ECOGUIADA
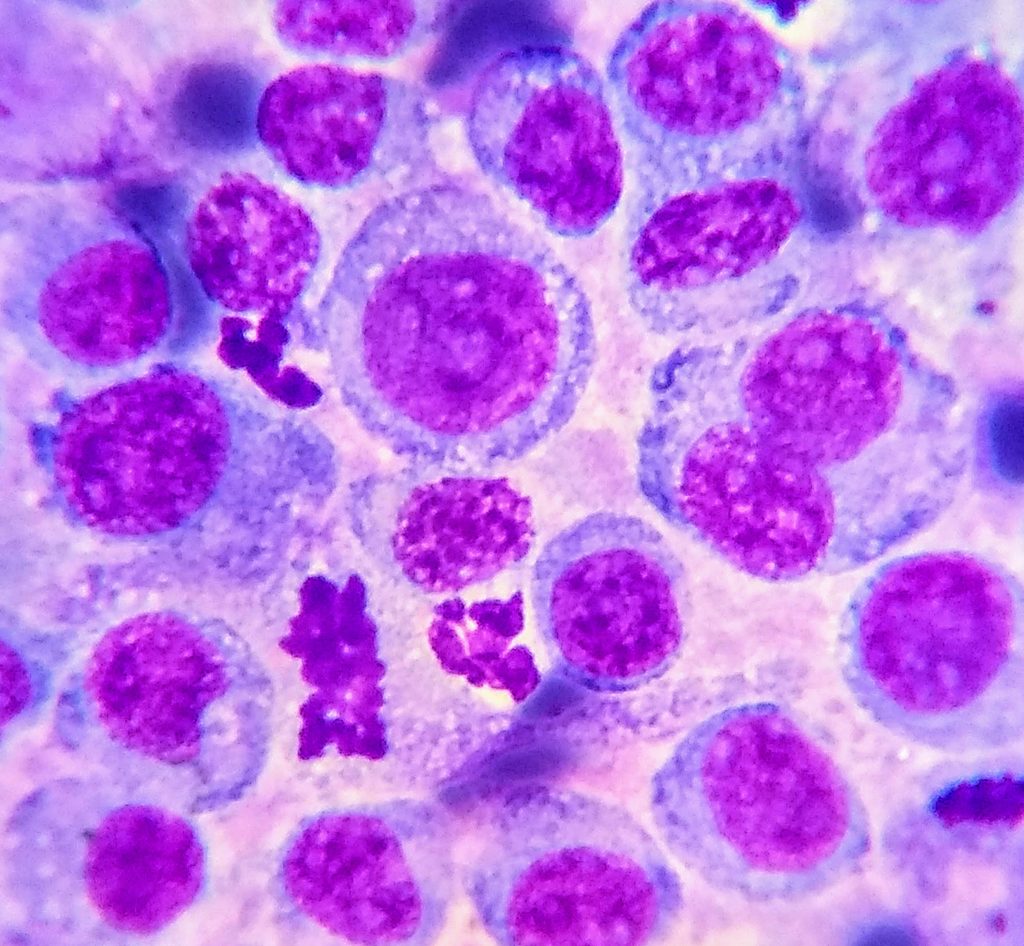
La citología ecoguiada es una herramienta que en medicina veterinaria, y sobre todo aquí en Argentina está poco explotada y difundida. Esta técnica nos permite obtener un diagnóstico presuntivo de manera rápida y mínimamente invasiva. La eficacia de la misma varía según reportes, estudios y órganos y patologías a evaluar rondando entre un 80-90% (DeBerry et al. 2002; Bahr et al. 2013; Reichle JK 2000); según experiencia del autor la eficiencia en patologías pulmonares es de un 94% (En reporte) y en órganos parenquimatosos incluyendo: hígado, linfonodos, glándula adrenal, estómago, vejiga, próstata, masas peritoneales y mediastínicas, del 92% (no reportada).
La citología como método diagnóstico, y como toda técnica tiene sus ventajas y sus limitaciones, siendo necesario conocerlas para su óptima utilización. Una de las principales características a favor es la capacidad de dar un diagnóstico rápido: en medicina humana la posibilidad de diagnóstico durante la maniobra está bien demostrada y mejor la eficiencia diagnóstica (Chandra et al. 2014). Como nota de autor, corroboramos siempre en el momento de la toma de muestra (in-situ) para evaluar la viabilidad de la misma (*ver más adelante descripción). Otra ventaja es la mínima invasividad debido a que el uso de agujas de calibre 21 a 25 G tienen nulas o escasas complicaciones (Arai et al. 2019). En nuestra experiencia las complicaciones varían según el órgano del cual se obtiene la muestra, rondando entre el 0 al 1%, siendo las mismas el sangrado peritumoral y/o dolor con mínimas consecuencias para el paciente. Como último punto a favor en ciertos subtipos histológicos tumorales, como las neoplasias de células redondas, la citología permite una mejor visualización citomorfología y alta correlación histopatológica. La principal desventaja es la imposibilidad de dar un diagnóstico definitivo debido a que el gold estándar es la histopatología, aunque la buena correlación existente permite realizar una asociación; cabe aclarar que no todos los órganos permiten esta estimación como veremos en secciones siguientes.
BIOPSIA ECOGUIADA
Determinadas enfermedades por sus características fisiopatológicas, histológicas o ecográficas, o incluso individualidades del paciente, requieren estudio histopatológico como única ruta diagnóstica sin la necesidad de la citología, recordemos que es el “Gold Standard”. En otros casos la citología no permite diagnóstico debido a el material obtenido o se requiere complementar con el análisis histopatológico por que la misma no es concluyente o corresponde a más de un diagnóstico. La biopsia mediante aguja tru-cut manual o automática es una técnica que nos permite obtener una definición arquitectural del tejido e incluso la posibilidad de realizar inmunohistoquímica (IHQ).
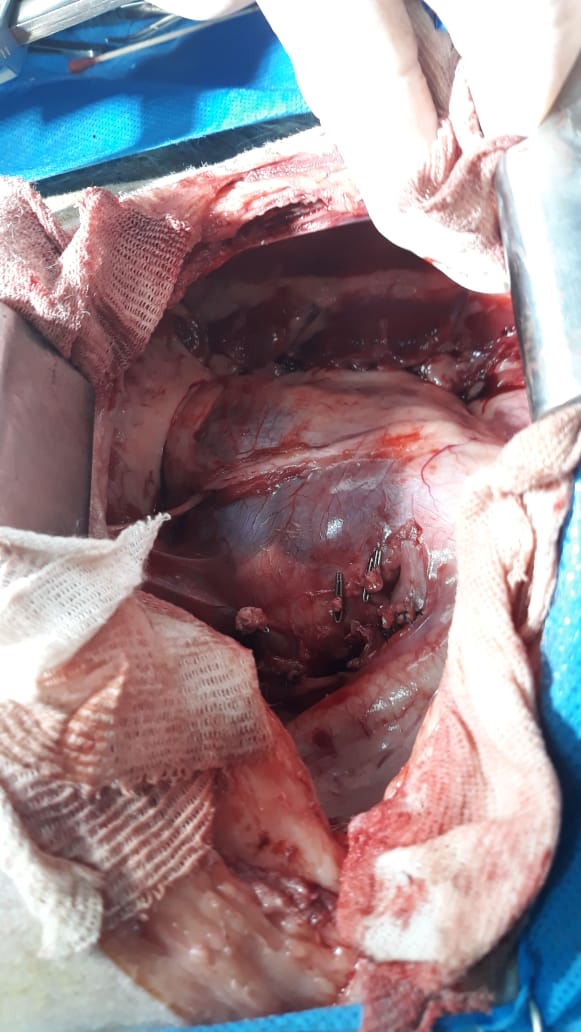
La tasa de complicaciones cuando se utiliza la aguja de core o tru-cut es variable según artículos y clasificadas en general en menores y mayores, siempre haciendo referencia al sangrado o hemorragia como principal problema. Un artículo sobre biopsias ecoguiada en caninos y felinos en 434 pacientes en diferentes órganos (Bigge et al. 2001), tenía tasas de complicaciones menores del 21 % con descenso de 10 ptos de hto sin necesidad de corregir y 6% clasificadas como mayores (la mayoría de estas en riñón) con necesidad de transfusión e impacto en el paciente. Por otro lado, un artículo de (Reece et al. 2020) en 102 caninos con biopsia por tru-cut ecoguiada con punto de corte de descenso mayor o menor a 6 puntos de hto para complicaciones, tenía un 42.2% de hemorragia, pero solamente un 1.9% de complicaciones (muerte o resucitación). En nuestra experiencia no reportada con 15 pacientes, caninos (13) y felinos (2) no hubo necesidad de intervención ni terapia de sostén en 14 de ellos, teniendo como resultado muerte súbita en un paciente felino por hemorragia activa en hígado (imagen); como experiencia del autor no se recomienda el uso de dispositivos automáticos para toma de biopsia en felinos y sustentado por (Proot and Rothuizen 2006).
TÉCNICA ECOGUIADA
Lo primero que debe asegurarse el oncólogo es verificar la factibilidad de la punción. El ecografista debe realizar un estudio completo y detallado del paciente para localizar la lesión o el tejido afectado, determinar la presencia de alteraciones en linfonodos satélites y la posibilidad de la toma de muestra de dicha lesión. Una vez evaluado el órgano afectado debemos mencionar si la alteración es difusa o focal, en esta última describir forma, tamaño, contornos, ecogenicidad, ecoestructura, ubicación y artefactos asociados, en base a ésto determinaremos su naturaleza (sólido/ líquido), por último la presencia de vasculatura intralesional y circundante (imagen).
La elección de la sonda a utilizar dependerá de la profundidad a la que se encuentre el tejido a punzar, los transductores microconvexos (5- 8 MHZ) y los transductores lineales (7.5- 10 MHZ) son los más frecuentemente utilizados en la práctica diaria, a mayor profundidad evaluada menor debe ser la frecuencia elegida. Uno de los ejemplos a tener en cuenta es que si la lesión se encuentra en la cavidad torácica, sólo podremos evidenciarla si la misma está ubicada en superficie cercana a la pleura, ya que la cortina de aire pulmonar atenúa el ultrasonido.
Toma de muestra
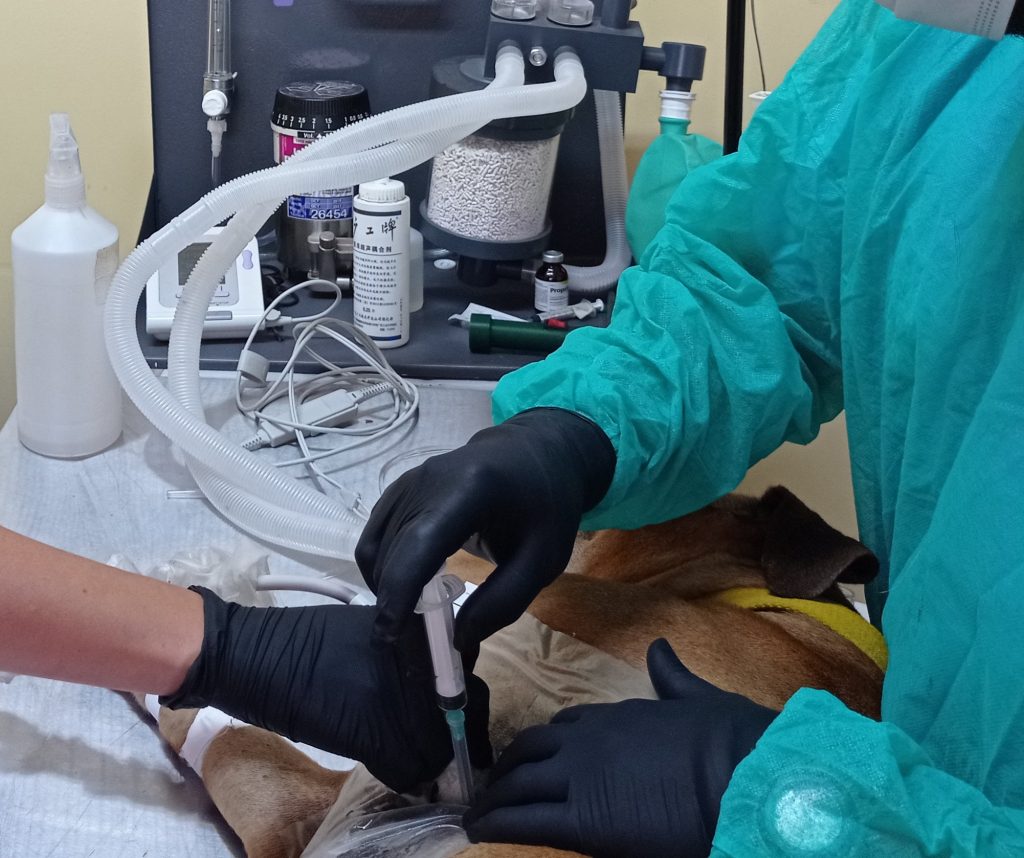
Se explicará la preparación y técnica de toma de muestra del paciente para ambas técnicas según el autor: citología y biopsia, haciendo hincapié en ciertas diferencias. Todos los pacientes que ingresan deben contar con estudios prequirúrgicos y de estadificación: electrocardiograma y ecocardiograma, radiografías de tórax en 3 vistas y análisis de sangre con perfil de coagulación y recuento plaquetario. Si bien la decisión del tipo de procedimiento de sujeción química (sedación o anestesia fija o inhalatoria) dependerá de las comorbilidades del paciente y decisión del anestesista o encargado de realizarla, se recomienda proceder con la maniobra con el paciente anestesiado. Esta metodología disminuirá considerablemente las complicaciones, facilitará la toma de muestra, mejorará la tasa diagnóstica y nos permitirá una técnica más sencilla.
- Posicionamiento adecuado.
- Preparación del paciente y la piel (tricotomía, asepsia, alcohol para evitar burbujas de aire entre el transductor y la piel, gel y protector estéril para la sonda). Se debe evitar el uso de gel en la piel para evitar artefactos en las muestras. (imagen)
- Identificación de la marca del transductor (siempre hacia craneal).
- Ubicación de la lesión en la pantalla.
- Decidir la técnica (manos libres, o con guía de biopsia).
- Transductor posicionado a 45 – 60° apoyado en la piel.
- Colocar la aguja a una distancia no mayor a 3 cm del transductor angulando a 45°.
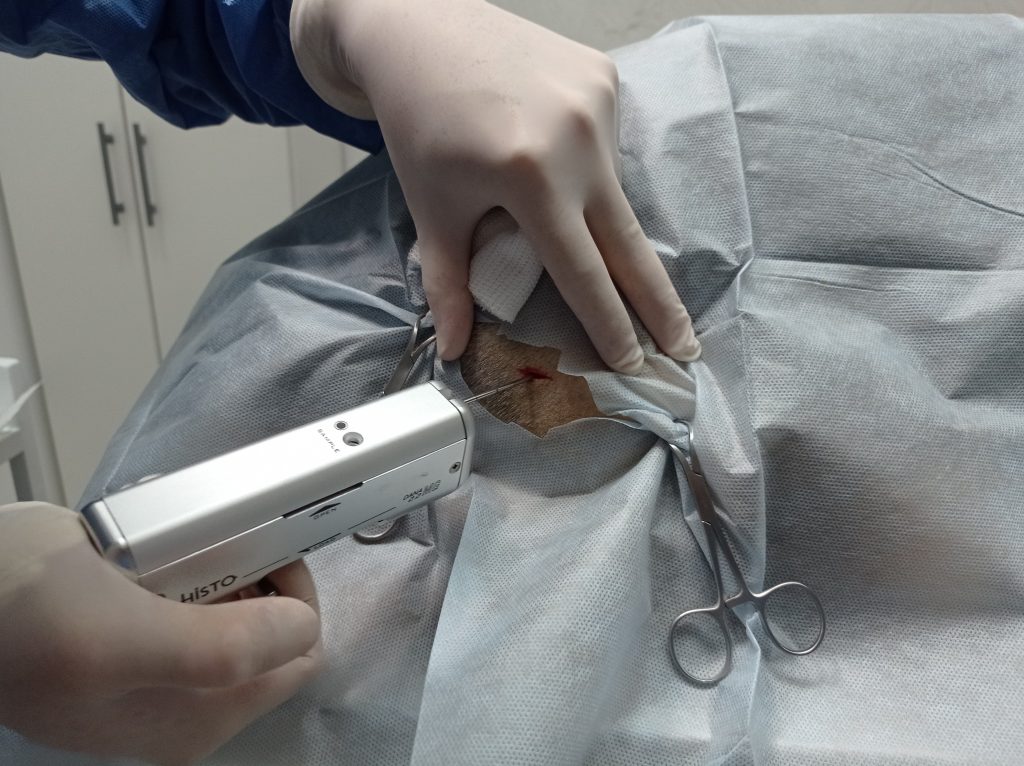
- Bisel hacia el transductor. En el caso de utilización de aguja tru-cut es necesario realizar un corte con bisturí de 1 cm incluyendo o no la fascia según el paciente para facilitar el paso de la aguja.
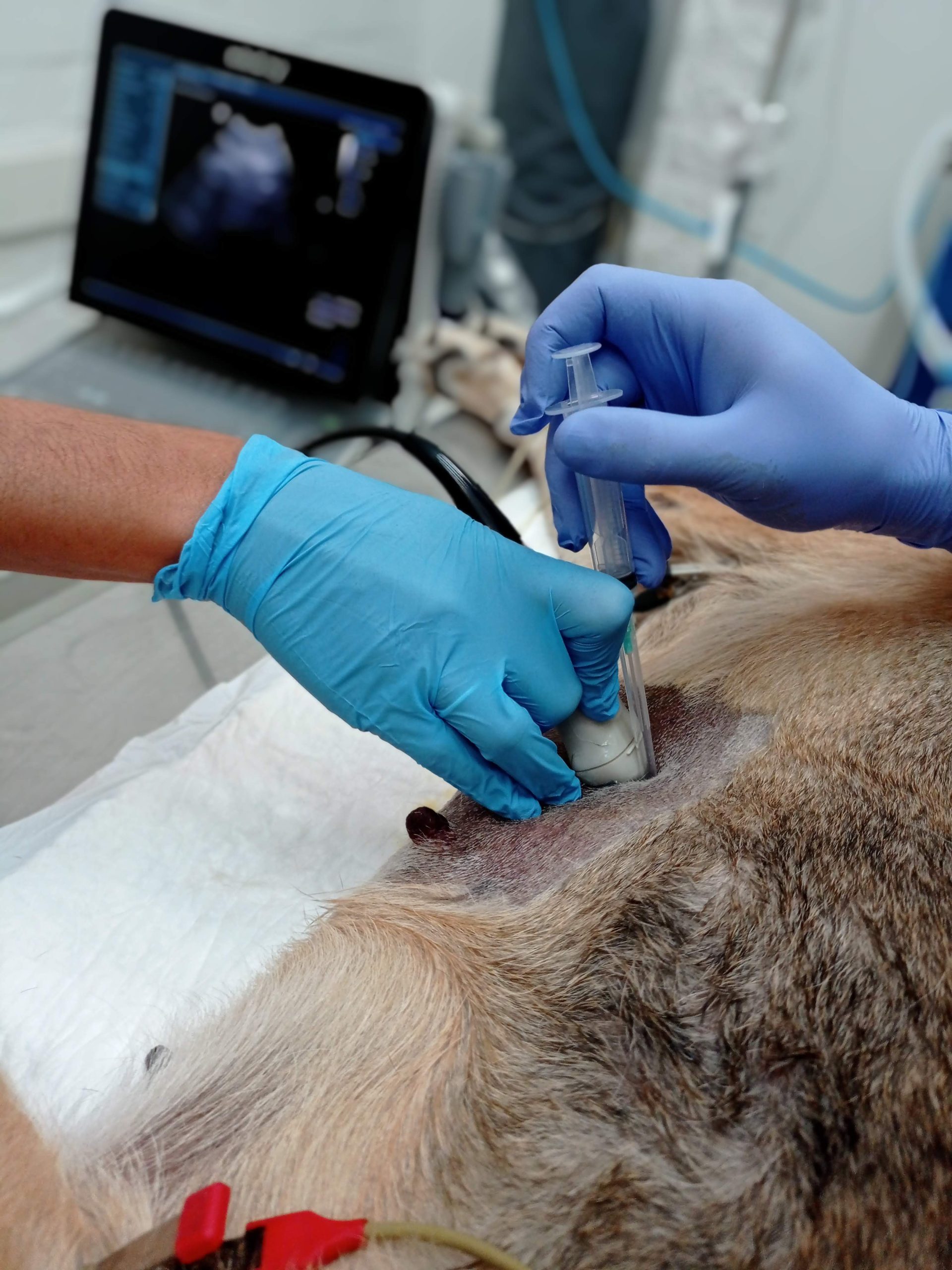
- Siempre ver la punta de la aguja. (imagen)
- Aspiración o no según la muestra.
- Extensión de la muestra, tincion rapida y corroborar por citopatólogo la viabilidad de la misma. De ser suficiente una muestra culminar el procedimiento o realizarlo hasta obtener una muestra correcta. (imagen)
- Una vez finalizada la punción controlar posibles hemorragias o reacciones circundantes. Realizar sutura de la piel en el caso de haber realizado biopsia.
El autor recomienda la verificación de la muestra in-situ, idealmente con citopatólogo, para corroborar que la misma presente material analizable y diagnosticable. Una vez obtenida la muestra se envía a su análisis detallado y minucioso. En el caso de no obtener muestras correctas se puede en el mismo momento transformar la técnica y realizar biopsia incisional tru-cut para poder eficientizar el momento anestésico del paciente y el tiempo que requiere la histopatología para su análisis.
UNA MIRADA CERCANA A DIFERENTES PATOLOGÍAS Y ÓRGANOS
Mediastino
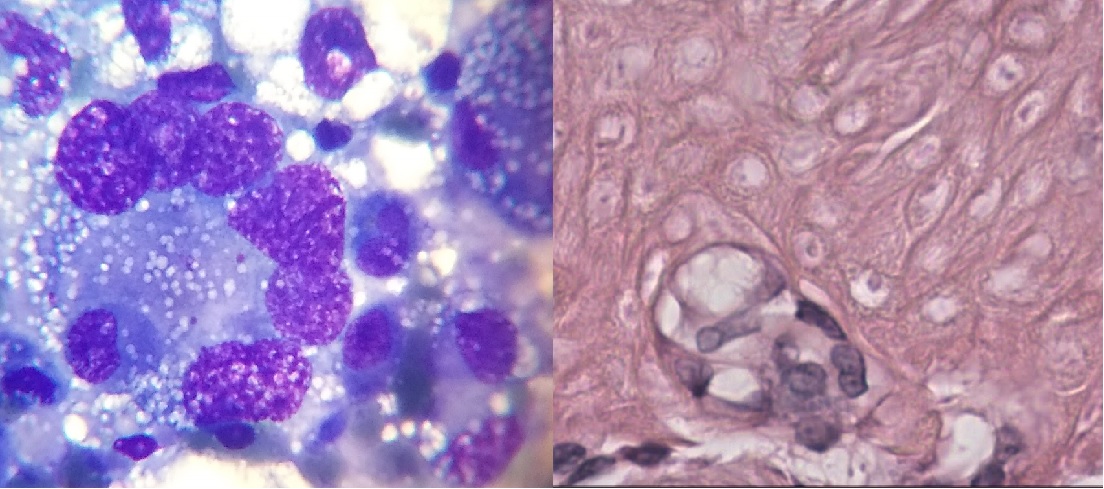
Las enfermedades que afectan al mediastino son similares en el gato y el perro, y en la mayoría de ellos es posible su identificación con análisis citológico. Las principales patologías oncológicas a diferenciar son el linfoma mediastínico y el timoma. La diferencia de ambas radica en el tratamiento, pronóstico y sobrevida, siendo el linfoma una enfermedad que requiere abordaje quimioterápico y pronóstico reservado, versus el timoma que requiere intervención quirúrgica y sobrevidas mayor a 750 días (felinos) 560 días (caninos); de aquí la importancia de contar con su diagnóstico. Las diferencias citomorfologicas de ambos radica en visualizar el componente epitelial del timoma (imagen), debido a que la presencia de linfocitos, linfoblastos puede ser encontrada en ambos; el hallazgo de mastocitos suele ayudar al diagnóstico de timoma. En algunos de estos pacientes es necesario complementar con el análisis histopatológico. Otras enfermedades presentes pueden ser el sarcoma histiocítico (imagen) o carcinoma ectópico.
Pulmón
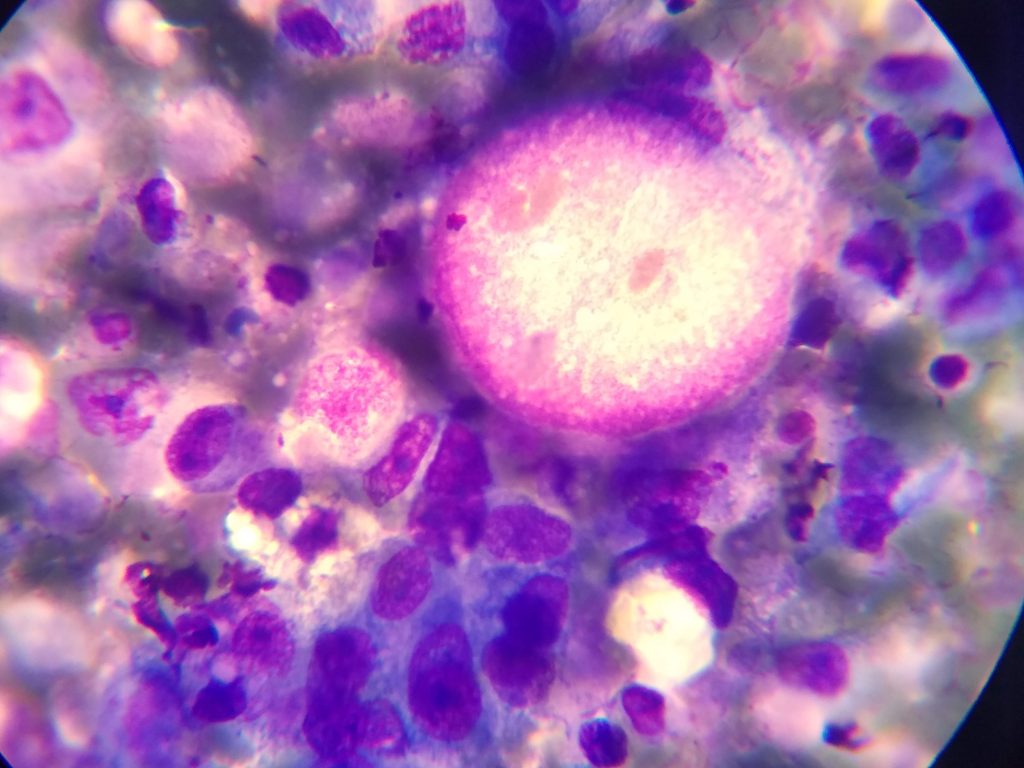
Los tumores primarios de pulmón son patologías de baja frecuencia en la especie canina y raros en los felinos. La histopatología los clasifica en carcinomas con sus diferentes subtipos, sarcomas y hematopoyéticos a grandes rasgos. Dos enfermedades comunes que suelen ser los principales diagnósticos diferenciales son el adenocarcinoma pulmonar (imagen) y el sarcoma histiocítico. Pocas veces los pacientes requieren el análisis histopatológico para obtener un diagnóstico debido a que la citología permite obtenerlo. La conducta terapéutica en general es la cirugía, pero el pronóstico es ampliamente diferente entre ambas patologías. La necesidad de un prediagnóstico correcto permite un tratamiento eficiente. Inclusive en pacientes con metástasis estables la confirmación de la misma para conducta terapéutica es factible de realizar (imagen). En pacientes no reportados en nuestra clínica el hallazgo de tumor venéreo transmisible, mastocitoma, linfoma pulmonar (imagen) respalda la necesidad de poder contar con el diagnóstico.
Hígado
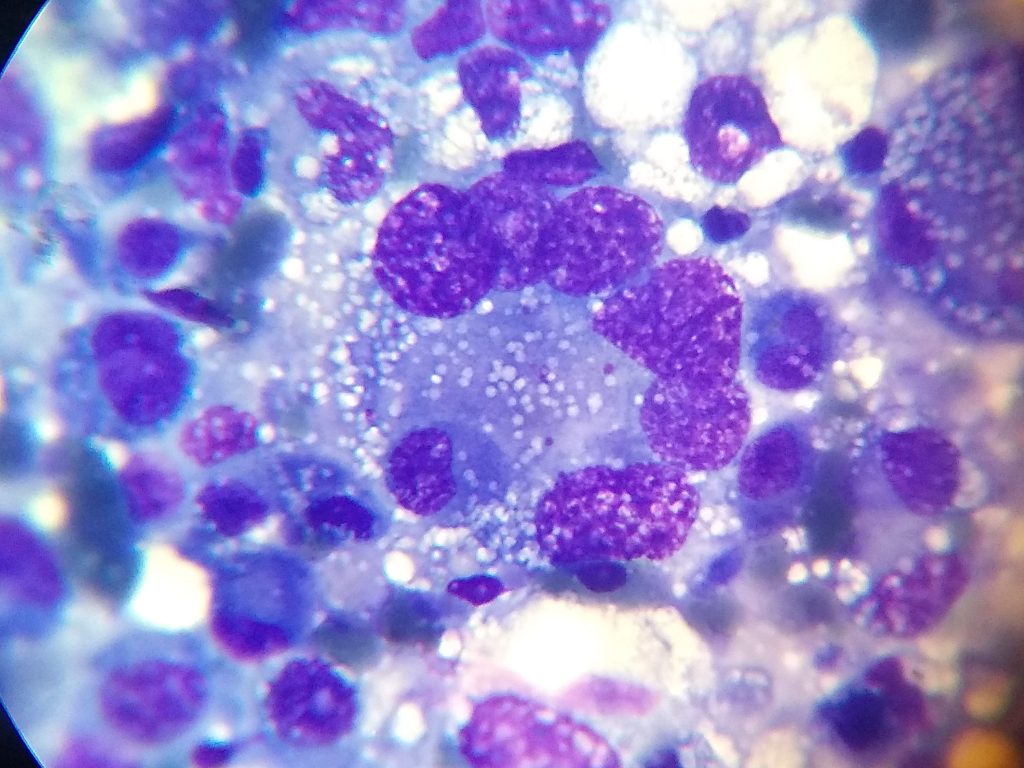
El hígado es un órgano afectado por múltiples cambios fisiopatológicos que provocan variaciones citomorfológicas. Las afecciones hiperplásicas, las degeneraciones vacuolares, los nódulos de regeneración, abscesos, los tumores benignos y malignos son las principales patologías encontradas en el parénquima hepático. La citología requiere un análisis minucioso debido a que los diversos cambios por ejemplo, pueden estar presentes en patologías oncológicas y no oncológicas. Un artículo de (Masserdotti and Drigo 2012) estandarizó los hallazgos citológicos necesarios para poder diferenciar carcinoma hepatocelular bien diferenciado de afecciones benignas, evaluando el conteo en 20 campos, disposición acinar, núcleos desnudos y capilares, en conjunto con multinucleación y aumento de la relación núcleo:citoplasma. En nuestra experiencia recomendamos la evaluación correcta de la pertinencia clínica de cada paciente, evaluando la necesidad de citología (imagen), biopsia tru-cut o laparotomía exploratoria con lobectomía hepática (imagen).
Próstata
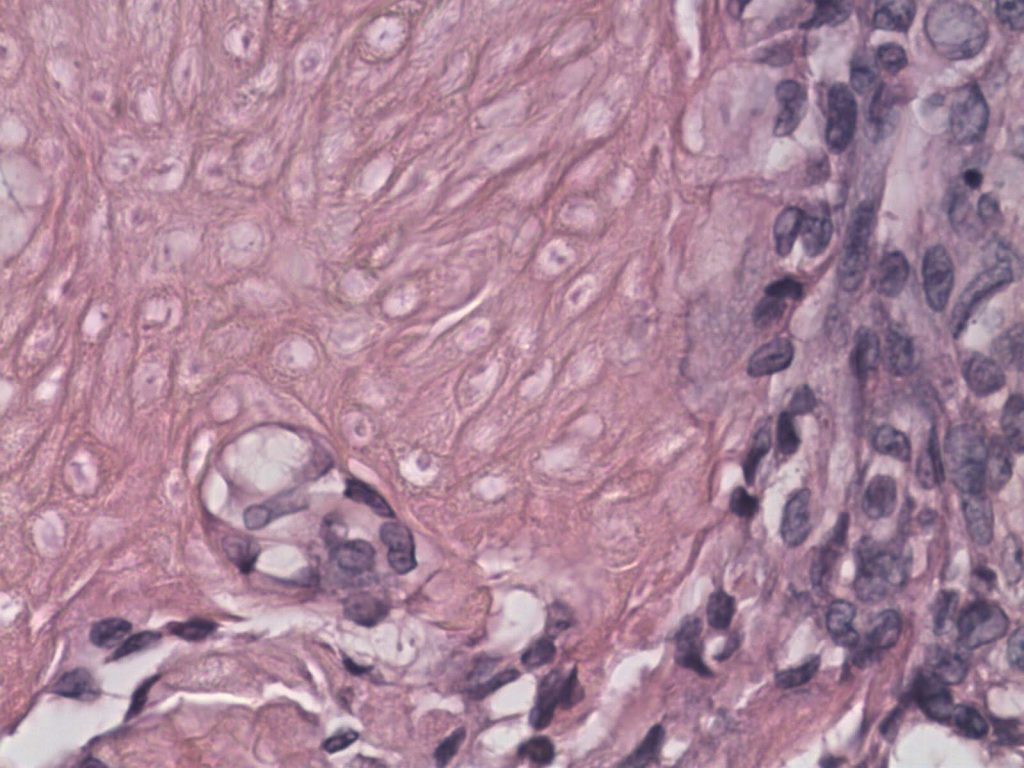
El carcinoma prostático es una enfermedad de baja prevalencia y alto potencial metastásico. El diagnóstico de la misma comprende historial clínico con una principal predisposición en perros castrados, gerontes y ecográficamente con cambios variables en próstata: heterogeneidad, irregularidad, mineralización, aumento moderado o marcado en su volumen. Si bien la tasa de siembra está reportada en escasos artículos, no es un impedimento para la realización de la técnica y nuestra experiencia no ha reportado hasta el momento su aparición. La citología debe ser interpretada minuciosamente y en conjunto con la clínica del paciente y hallazgos ecográficos. La diferenciación entre carcinoma urotelial (imagen) y adenocarcinoma prostático es posible con los hallazgos citológicos y es de importancia pronóstica según varios reportes. La citología debería ser utilizada cautelosamente o incluso descartada ante la posibilidad de absceso prostático.
Vejiga
La presencia de carcinoma urotelial comprende el 90% de las patologías oncológicas de la vejiga. Como sucede con la próstata la posibilidad de implantación está descrito en este tipo de neoplasias debido a la punción ecoguiada. Recomendamos el sondaje traumático mediante guía ecográfica con sonda nasogástrica acanalada y con presión negativa, para poder obtener las muestras citológicas (imagen) e inclusive poder obtener fragmentos de tejido para estudio histopatológico (imagen).